相比传统锂离子电池,锂氧气电池具有容量高、环境友好等优势。近年来,针对锂氧气电池存在的充放电反应动力学缓慢,充电过电势大等问题,科研工作者开发了多种液相催化剂以解决正极传质动力学问题,从而有效促进Li2O2的形成和分解。然而,液相催化剂普遍存在的“穿梭效应”会造成催化剂自身的不断消耗同时会导致金属锂负极的腐蚀,难以实现对充放电反应的持续调控,严重阻碍了电池的循环稳定性。因此,开发一种具有高催化活性、高稳定性且与Li2O2接触充分的催化剂对锂氧气电池的发展至关重要。
吉林师范大学冯明教授联合加拿大滑铁卢大学陈忠伟院士团队,在国际知名杂志《先进材料》(Advanced Materials)上,发表了题为“Self-formation CoO Nanodots Catalyst in Co(TFSI)2-Modified Electrolyte for High Efficient Li-O2Batteries”的重要论文,相关工作解决了液相催化剂稳定性和活性不能兼顾的问题,对于未来发展新体系锂空气电池具有重要意义。
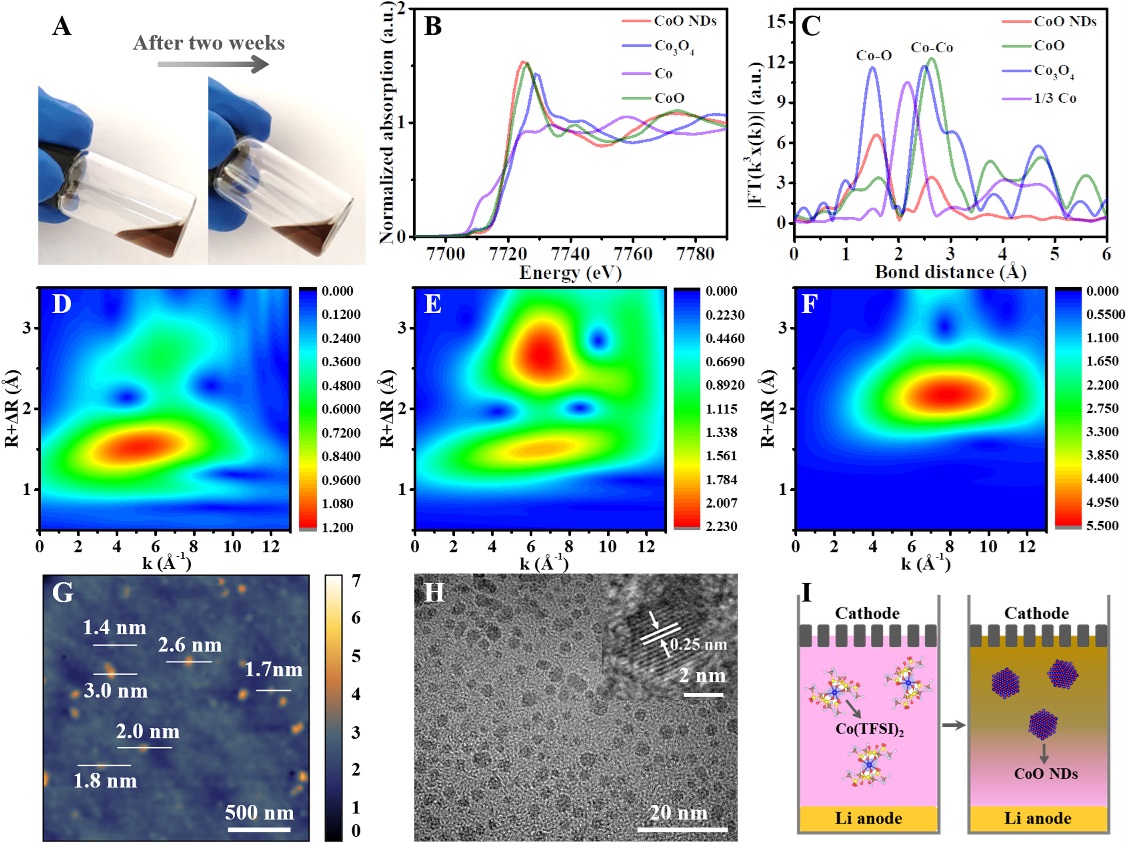
图1.CoO纳米点自源形成模拟实验及其结构表征
研究团队发现,基于过氧化物与Co(TFSI)2之间的自发反应,可以设计CoO纳米点在电化学过程中的自源形成过程。从而自发由液态催化剂生成为具有双重性质的可溶性CoO纳米点催化剂。综合多种表征方法,研究团队证明了在反应结束后,Co(TFSI)2转化为粒径大小在2-5 nm之间的纳米点,且高度分散在电解液中(图1)。电化学性能评估显示,与不含Co(TFSI)2添加剂的电池相比,含有Co(TFSI)2添加剂的电池电化学性能得到显著提升(图2)。此外,对电池循环后的电极进行观察发现,Co(TFSI)2作为电解液添加剂时,由于CoO纳米点的存在,电池放电后产生环形的放电产物,充电后环形放电产物全部消失。进一步的原位XRD结果则表明放电产物为Li2O2,Li2O2在放电反应过程中逐渐生成,充电反应结束后完全分解,证明Co(TFSI)2作为电解液添加剂时,由于自源生成了CoO纳米点,电池表现了良好的可逆性。

图2.Co(TFSI)2作为电解液添加剂的锂氧气电池电化学性能测试对比图
在本研究中,研究团队还通过自主搭建的电化学质谱(DEMS)系统测试了该电池体系的充放电效率与气体副产物(图3)。DEMS定量结果显示,该体系中,e-/O2的比为2.15,这说明在含Co(TFSI)2添加剂的锂氧气电池中,Li2O2的形成过程是基于两电子反应进行的(2Li++ 2e-+ O2→ Li2O2);该结果同时表明Li2O2的生成效率超过93%,证明了本研究中的高分散性的CoO纳米点的良好催化活性。最后,研究团队结合电化学测试结果和原位表征结果,详细分析了Co(TFSI)2作为添加剂,在充放电过程中自源性形成机理:在反应初始阶段,伴随可溶性LiO2和Li2O2的生成,Co(TFSI)2发生反应,CoO纳米点也随之产生,并溶解在电解液中。随着放电反应的进行,Li2O2的沉积,由于纳米点表面的静电作用,使之与Li2O2共同沉积在电极表面;充电时,与Li2O2共同沉积的CoO纳米点与Li2O2充分接触,能更加高效地促进Li2O2全部分解。同时在锂离子溶剂化结构和静电力的作用下,部分CoO纳米点沉积于电极表面,另一部分CoO纳米点重新分散在电解液中,用于催化后续的循环反应。由于高分散性CoO纳米点的催化作用同固态催化剂类似,且因为其小尺寸效应,使其能均匀分散在电解液中,具有类似液相催化剂的接触特点,因此,也被称之为具有固相、液相双重特性的新型催化剂。相比之下,不含CoO纳米点的锂氧气电池体系,放电产生膜状的Li2O2,其会堵塞多孔通道、阻止电荷运输,使Li2O2在充电过程中不能完全分解,产生大量的副产物,影响电池的循环寿命。
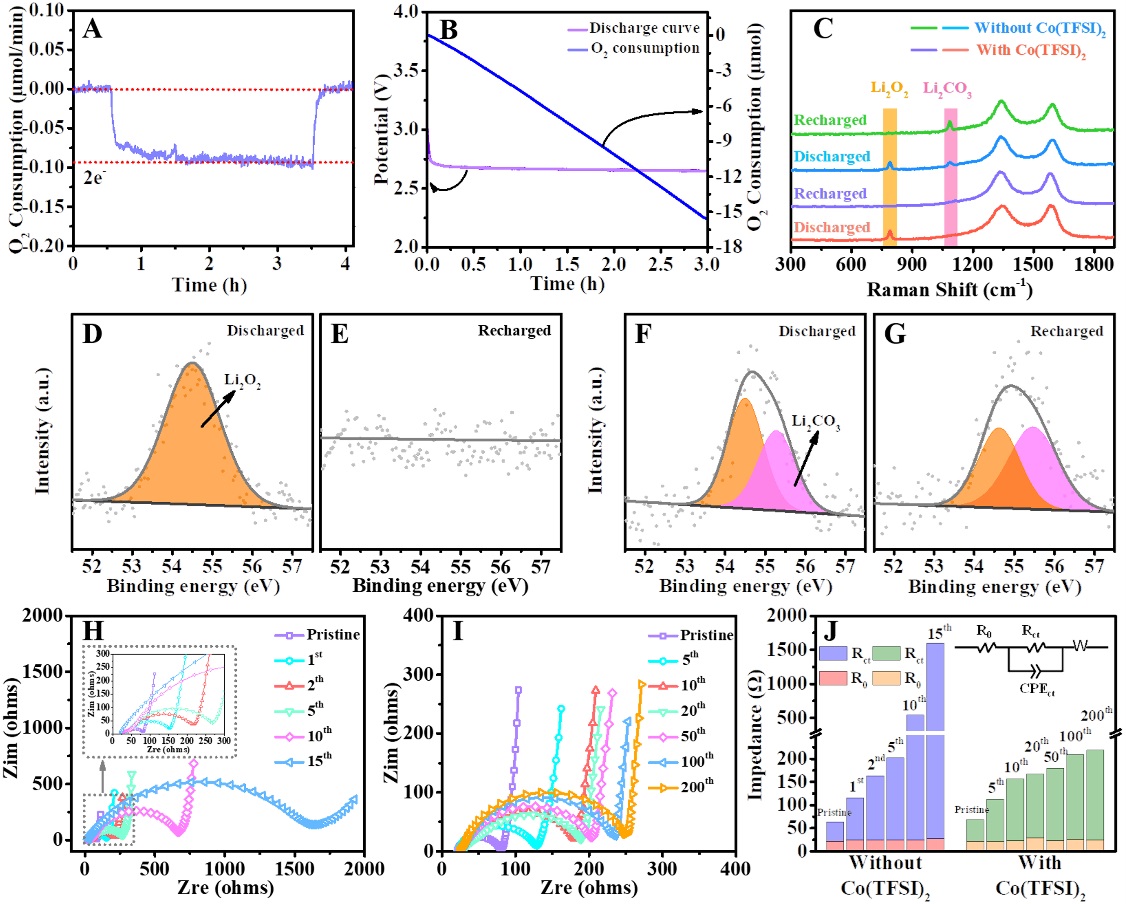
图3.含Co(TFSI)2的锂氧气电池放电过程中氧气消耗/释放结果以及电极表面产物残留情况
本工作率先提出了自源性生成催化剂的新理念;同时,打破了传统固相、液相催化剂之间的界限,构建了具有双重优势的可分散纳米点催化剂。一方面为开发锂空气电池催化剂体系扩展了新的思路,另一方面为设计新型智能锂空气电池体系做了新的探索。同时,该方法相对于传统的电解液改性方法,具有成本低廉、操作简便等特征,有利于电池的产业化发展。
吉林师范大学孙桂儒博士、高睿博士为论文第一作者,吉林师范大学冯明教授、滑铁卢大学陈忠伟教授为论文的共同通讯作者。该成果得到了国家自然科学基金面上项目及吉林省重点研发项目的资助。
文章链接: https://doi.org/10.1002/adma.202201838.